Groupe Fat10 - Pr Réjane Paumelle-Lestrelin
Présentation de la recherche thématique
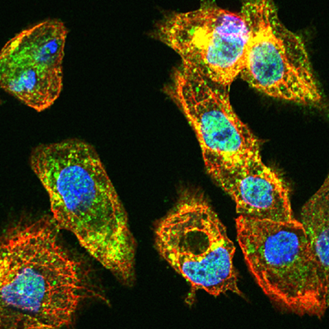
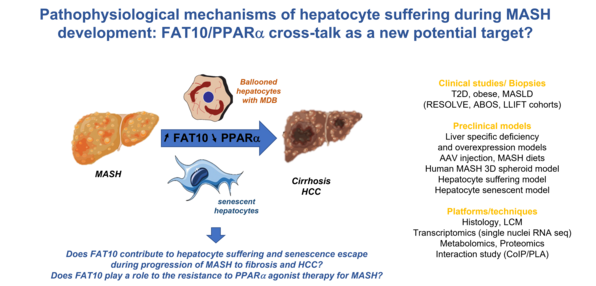
La MASLD, une maladie du foie liée aux troubles du métabolisme, touche aujourd’hui près d’un quart de la population mondiale et progresse rapidement, en particulier chez les personnes obèses ou diabétiques. Cette pathologie, souvent silencieuse, peut évoluer d’une simple accumulation de graisse dans le foie vers une forme inflammatoire sévère, la MASH, susceptible de conduire à une cirrhose ou à un cancer du foie. Avec une prévalence en constante augmentation, la MASLD est appelée à devenir la première cause de transplantation hépatique dans les prochaines décennies. Dans les formes sévères, les cellules du foie qu’on appelle hépatocytes deviennent « ballonisées » et/ou sénescentes: elles gonflent et accumulent des amas anormaux de protéines appelés corps de Mallory-Denk. La présence de ces cellules est un signe de souffrance hépatique importante, mais les mécanismes qui conduisent à leur apparition restent encore mystérieux. Malgré l’ampleur du problème, les traitements disponibles sont rares et souvent insuffisants. Certains médicaments prometteurs, comme les agonistes de PPARα, n’ont pas réussi à stopper ou inverser la maladie, ce qui montre que nous ne comprenons pas encore pleinement pourquoi certains patients répondent mal aux thérapies.
Dans ce contexte, notre groupe de recherche s’engage à comprendre en profondeur les mécanismes cellulaires et moléculaires qui sous-tendent la progression de la maladie. Nous cherchons à identifier les facteurs qui entraînent l’inflammation chronique du foie, la souffrance des cellules hépatiques et, à terme, l’apparition de complications graves. Mieux comprendre ces mécanismes est une étape indispensable pour développer des stratégies thérapeutiques adaptées. Notre équipe s’appuie sur une approche intégrée combinant plusieurs niveaux d’étude : des modèles murins afin d’examiner l’évolution de la maladie dans un organisme complet ; des analyses cellulaires et moléculaires in vitro pour décrypter finement les voies biologiques impliquées ; et des études translationnelles permettant de rapprocher nos découvertes des réalités cliniques et des besoins des patients. Grâce à cette complémentarité, nous avons récemment identifié FAT10/UBD, une protéine de la famille des ubiquitine-like, comme un acteur potentiel de la progression de la maladie. Cette découverte ouvre des perspectives prometteuses pour le développement de nouvelles cibles thérapeutiques, au moment même où la communauté médicale et scientifique cherche des solutions capables d’agir sur les formes les plus sévères de la maladie. À travers ces travaux, notre ambition est de contribuer à l’amélioration de la prise en charge des patients et de participer à l’effort collectif visant à freiner la progression de cette maladie métabolique en pleine expansion.
Mots-clès
MASLD ; MASH ; récepteurs nucléaires ; FAT10/UBD ; souffrance hépatique ; maladie métabolique ; inflammation
Réjane Paumelle-Lestrelin, PhD, HDR
Professeure des Universités, Université de Lille, Responsable de groupe
ORCID : 0000-0002-4489-0717
rejane.lestrelin[@]univ-lille.fr
Professeure de Biologie Cellulaire au sein du département de pharmacie de l’UFR3S de l’Université de Lille depuis 2009, je consacre mes travaux à la compréhension fine des mécanismes cellulaires et moléculaires qui sous-tendent les maladies cardiométaboliques, avec l’ambition de contribuer à l’émergence de nouvelles stratégies thérapeutiques. Mes recherches s’inscrivent au croisement de la biologie fondamentale et des enjeux cliniques majeurs liés au métabolisme et aux pathologies cardiovasculaires. Titulaire d’un doctorat en Sciences de la Vie et de la Santé obtenu en 2000 à l’université de Lille au sein de l’Institut de Biologie de Lille (EP560), j’y ai exploré les voies de signalisation activées par l’HGF/SF et son récepteur Met dans des cellules épithéliales cancéreuses, contribuant à une meilleure compréhension de mécanismes clés de la tumorigenèse. J’ai ensuite poursuivi mon parcours scientifique au sein de l’U545, sous la direction du Pr Bart Staels, où mon post-doctorat a porté sur les propriétés anti-inflammatoires des statines et le rôle central du récepteur nucléaire PPARα dans les macrophages, un travail qui a renforcé mon intérêt pour les interactions entre inflammation, métabolisme et signalisation cellulaire. Ma carrière académique s’est structurée à partir de 2005, lorsque j’ai obtenu un poste de Maître de Conférences, me permettant d’intégrer l’UMR1011 dirigée par le Pr Bart Staels. Après l’obtention de mon habilitation à diriger des recherches en 2008, j’ai été successivement nommée Professeure des universités 1ère classe en 2009, promue 2ème classe en 2018, puis classe exceptionnelle en 2022. Aujourd’hui, mes activités de recherche se concentrent sur l’étude des mécanismes cellulaires et moléculaires impliqués dans les maladies cardiovasculaires et métaboliques, en particulier la stéatohépatite métabolique (MASH). Mon objectif est d’identifier des cibles biologiques innovantes et de contribuer au développement de solutions thérapeutiques à fort potentiel pour ces pathologies en pleine expansion.
Principales collaborations :
U1011 : équipe 2, 4 et 6
U1190 : équipe de F. Pattou et G.Lassailly (Centre Hospitalier Régional Universitaire de Lille, Service chirurgie digestive et transplantation de Lille CHU Lille),
U1177 : équipe de B.Déprez (IPL, Lille)
U8161 : équipe de C Abbadie (OncoLille)
Société Genfit SA (Lille),
TWI2N : S.Francque (Hôpital universitaire d’Anvers, Department of gastroenterology hepatology and translational sciences in inflammation and immunology, Anvers, Belgique.
Cyril Bourouh, PhD
Ingénieur de recherche, Université de Lille
ORCID : 0000-0003-0206-0915
Titulaire d’un doctorat en Aspects Moléculaires et cellulaires de la biologie obtenu en 2021, j’ai pu étudier sous la direction du Dr Jean-Sébastien Annicotte au sein de l’UMR1283 (Pr Philippe Froguel), le rôle du facteur de transcription E2F1 dans la fonction (sécrétion d’insuline en réponse au GLP-1) et l’identité de la cellule β pancréatique au cours du diabète de type II. J’ai ensuite poursuivi ma formation scientifique par un post-doctorat dans l’équipe du Dr Amélie Bonnefond, où j’ai étudié le rôle du récepteur aux opioïdes (OPRD1) dans la fonction de la cellule β pancréatique. Désireux de découvrir un nouvel environnement scientifique, j’ai par la suite réalisé un deuxième post-doctorat au sein de l’UMR1011, sous la direction du Pr Réjane Paumelle-Lestrelin, où j’ai étudié le rôle de Fat10 dans la formation des corps de Mallory-Denk au cours de la MASH (Projet France Relance). Actuellement, ingénieur de recherche, je travaille sur le développement et la caractérisation d’un modèle murin de délétion de Fat10 dans l’hépatocyte, qui permet de mieux étudier le rôle et les fonctions de Fat10 dans le développement de la MASH, de la senescence, ainsi que dans la formation des corps de Mallory-Denk. En parallèle de mes activités de recherche au sein de l’UMR, j’ai également en charge des missions d’appui à la recherche, notamment sur la gestion de la communication de l’unité (mise à jour du site internet, gestion du compte LinkedIn), l’organisation des réunions de laboratoire, la mise en place et le suivi de procédures d’hygiène et sécurité (Assistant de prévention), et d’autres missions de gestion au sein de l’unité.
Chloé Blondel, PhD
Attaché temporaire d'enseignement et de recherche, Université de Lille
ORCID : 0009-0007-0156-689X
Cindy Nguyen, PhD
Attaché temporaire d'enseignement et de recherche, Université de Lille
ORCID : 0009-0003-2718-3230
Titulaire du diplôme d’État de Docteur en pharmacie obtenu à Montpellier, j’ai orienté mon parcours vers la recherche académique. J’ai réalisé un doctorat en sciences biologiques au sein du laboratoire de la barrière hémato-encéphalique (LBHE) de l’Université d’Artois, sous la direction du Pr Fabien Gosselet. Mes travaux de thèse ont porté sur l’impact des oxystérols sur la barrière hémato-encéphalique dans un contexte de maladies neurodégénératives.
Je suis actuellement ATER à l’UMR 1011 dans l’équipe du Pr Réjane Lestrelin. En parallèle de mes activités d’enseignement en physiologie à la Faculté de Pharmacie de Lille, mes recherches se concentrent sur les mécanismes de résistance de PPARα à ses agonistes dans le contexte de la MASH.
Arthur Cens,
Etudiant en thèse, Université de Lille
Actuellement doctorant au sein de l’équipe 1 de l’UMR1011, je travaille sur le projet de thèse intitulé “Rôle de FAT10 dans la formation des corps de Mallory-Denk au cours du développement de la MASH”. Préalablement, j’ai obtenu une licence en BCPA (Biologie Cellulaire et Physiologie Animale) avant de suivre le Master BBRT (Biologie Biotechnologie Recherche Thérapeutique) à l’Université de Nantes. Mon cursus était très axé sur la physiologie cardiovasculaire et respiratoire ainsi que sur la biologie de l’appareil locomoteur. J’ai effectué mes stages de master dans l’équipe muscle de l’UMR-1089/TaRGeT en travaillant sur la Dystrophie musculaire de Duchenne (DMD) et en étudiant l’expression du canal TRPC3 et celle de la NAPDH oxidase NOX2 dans des modèles in vivo et in vitro. J’ai ensuite travaillé 1 an en tant qu’ingénieur d’étude et j'ai mis au point la génération d’organoïdes musculaires à partir d’iPSC. Aujourd’hui, grâce à la bourse de thèse que j’ai obtenue au concours de l’école doctorale, j’étudie l’implication d’une ubiquitin like modifier dans la formation d’agrégats protéiques dans un contexte de souffrance hépatocytaire (la ballonisation) au cours de la MASH. Lors de ces études, j’ai eu l’occasion de travailler au niveau clinique avec les données transcriptomiques de différentes cohortes de patients obèses, couplés à des études in vivo et in vitro.
Actualités récentes :
- Obtention d'un financement ANR PRC "Fat10MASH" de 430 000 euros pour étudier le rôle de Fat10 dans le développement de la souffrance hépatocytaire et de la résistance aux agonistes de Ppara
- Participation et co-organisation de la fête de la science 2025 sur le thème "Intelligence"
Les compétences développées au sein du groupe Fat10 sont :
- Biologie cellulaire : modèles de souffrance et de sénescence hépatocytaire (lignées hépatocytes humains, hépatocytes primaires murins)
- Histologie : Immunohistochimie, immunofluorescence, RNAscope, Microscopie confocale
- Biologie moléculaire : PCR en temps réel, western-blot, Co-IP, PLA, protéomique.
- Modèles précliniques : modèles génétiquement modifiés, infection virale, modèles de MASH, fibrose, inflammation aigüe, sepsis
- Études cliniques : analyses histologiques et omics de prélèvements de foie humain.
Liste des diffèrentes publications du groupe Fat10 :
Clavreul L, Bernard L, Cotte AK, Hennuyer N, Bourouh C, Devos C, Helleboid A, Haas JT, Verrijken A, Gheeraert C, Derudas B, Guille L, Chevalier J, Eeckhoute J, Vallez E, Dorchies E, Van Gaal L, Lassailly G, Francque S, Staels B, Paumelle R. The ubiquitin-like modifier FAT10 is induced in MASLD and impairs the lipid-regulatory activity of PPARa. Metabolism. 2024 Feb:151:155720. doi: 10.1016/j.metabol.2023.155720.
Bobowski-Gerard M, Boulet C, Zummo FP, Dubois-Chevalier J, Gheeraert C, Bou Saleh M, Strub JM, Farce A, Ploton M, Guille L, Vandel J, Bongiovanni A, Very N, Woitrain E, Deprince A, Lalloyer F, Bauge E, Ferri L, Ntandja-Wandji LC, Cotte AK, Grangette C, Vallez E, Cianférani S, Raverdy V, Caiazzo R, Gnemmi V, Leteurtre E, Pourcet B, Paumelle R, Ravnskjaer K, Lassailly G, Haas JT, Mathurin P, Pattou F, Dubuquoy L, Staels B, Lefebvre P, Eeckhoute J. Functional genomics uncovers the transcription factor BNC2 as required for myofibroblastic activation in fibrosis. Nat Commun. 2022 Sep 10;13(1):5324. (IF: 17,69).
Grzych G, Chávez-Talavera O, Descat A, Thuillier D, Verrijken A, Kouach M, Legry V, Verkindt H, Raverdy V, Legendre B, Caiazzo R, Van Gaal L, Goossens J-F, Paumelle R, Francque S, Pattou F, Haas JT, Tailleux A, Staels B. NASH-related increases in plasma bile acid levels depend on insulin resistance. JHEP Report. 2020, Dec. (IF: 7).
Grzych G, Vonghia L, Bout MA, Weyler J, Verrijken A, Dirinck E, Chevalier Curt MJ, Van Gaal L, Paumelle R, Francque S, Tailleux A, Haas JT, Staels B. Plasma BCAA Changes in Patients With NAFLD Are Sex Dependent. J Clin Endocrinol Metab. 2020 Jul 1;105(7) (IF: 5,65).
Deleye Y, Cotte AK, Hannou SA, Hennuyer N, Bernard L, Derudas B, Caron S, Legry V, Vallez E, Dorchies E, Martin N, Lancel S, Annicotte JS, Bantubungi K, Pourtier A, Raverdy V, Pattou F, Lefebvre P, Abbadie C, Staels B, Haas JT, Paumelle R. CDKN2A/p16INK4a suppresses hepatic fatty acid oxidation through the AMPKα2-SIRT1-PPARα signaling pathway. J Biol Chem. 2020 Oct 9:jbc.RA120.012543 (IF: 5,157).
Paumelle R*, Haas J*, Hennuyer N*, Bauge E*, Deleye Y, Mesotten D, Langouche L, Vanhoutte J, Cudejko C, Wouters K, Hannou SA, Legry V, Lancel S, Lalloyer F, Polizzi A, Smati S, Gourdy P, Vallez E, Bouchaert E, Derudas B, Dehondt H, Gheeraert C, Fleury S, Tailleux A, Montagner A, Wahli W, Van Den Berghe G, Guillou H, Dombrowicz D, Staels B. Hepatic PPARα is critical in the metabolic adaptation to sepsis. J Hepatol. 2019 Jan 21. pii: S0168-8278(19)30027-3. *contribute equally as first co-authors (IF=25,083).
Liste des financeurs du groupe Fat10 :
Liste des anciens membres du groupe Fat10 :
Lucie Bernard, Etudiante en thèse (2019-2024)
Ludivine Clavreul, Etudiante en thèse (2018-2023)
Sadia Raab, Chercheure post-doctorante (2022-2024)
Fabienne Glacial, Ingénieure d'étude (2022-2024)
Claire Devos, Ingénieure d'étude (2022-2024)