Theme 3: Dialogue immuno-métabolique dans l’obésité et ses comorbidités
Présentation de la thématique de recherche
L’obésité atteint des proportions épidémiques dans le monde entier et prédispose à des dérégulations métaboliques, précipitant le développement de pathologies tels que les dyslipidémies, les MASLD et le diabète de type 2 (DT2). Ces troubles métaboliques augmentent le risque de complications cardiovasculaires suite au développement d’athérosclérose dans les artères coronaires et l’altération muscle cardiaque et de la fonction des valves, une condition référencée sous le nom de maladie cardiométabolique. Il est reconnu que ces maladies impliquent des altérations dans les interactions entre plusieurs organes. Il est important de noter que les altérations des fonctions immuno-inflammatoires (thème principal de l’équipe 3), contribuent à augmenter le risque cardiovasculaire et des données récentes ont montré qu’un mauvais contrôle métabolique agit en parallèle avec les altérations du système immunitaire pour précipiter la progression de la maladie. Il est donc important, non seulement d’étudier le rôle de chaque organe individuellement dans les maladies cardiométaboliques, mais aussi d’étudier l’altération de la communication inter-organes dans ce contexte pathologique. Ainsi, l’équipe 3 étudie les mécanismes impliqués dans la communication entre le système immuno-inflammatoire et le métabolisme, en particulier dans le contexte des maladies métaboliques (Obésite, DT2, MASLD et leurs complications cardiovasculaires), mais également dans les maladies inflammatoires tels que le psoriasis. L’équipe 3 utilise différentes approches complémentaires, tels que des modèles murins, des études moléculaires in vitro et de la recherche translationnelle en se concentrant sur les cellules immunitaires de différents organes (foie, cœur, tissus adipeux), ainsi que dans tissus plus classiques (sang, moelle osseuse et dans les organes « barrières » comme la peau). La réalisation de ces objectifs nécessite des compétences pluridisciplinaires et des approches translationnelles. C’est pourquoi l’équipe 3 a développé ses projets en étroite collaboration avec les autres équipes de l’unité, permettant des approches de biologie de l’organisme entier et des systèmes.
Mots-clés
Inflammation ; Cellules Immunes ; Récepteurs nucléaires ; Diabètes de Type 2 ; Obésité ; Athérosclérose ; MASH ; MASLD ; Psoriasis ; Dermatite atopique ; Asthme allergique
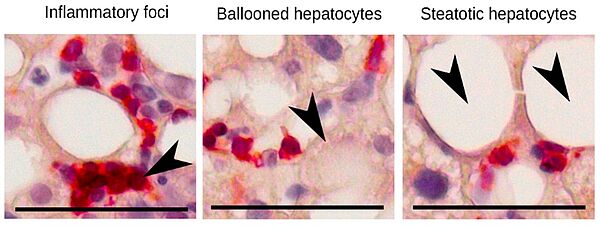
Présence de Lymphocytes CD8 cytotoxiques dans un foyer inflammatoire et à proximité d’hépatocytes ballonisés dans le foie de patient atteins de Stéatohépatite associé à une dysfonction métabolique (MASH) (from Haas et al. Nat Metab. 2019)
David DOMBROWICZ
Chef d'équipe. Directeur de Recherche. INSERM
david.dombrowicz[@]inserm.fr david.dombrowicz[@]pasteur-lille.fr david.dombrowicz[@]univ-lille.fr
ORCID Number : 0000-0002-0485-8923
Jonas SONDERGAARD
Chef d’équipe émergente. Institut Pasteur de Lille.
jonas.sondergaard[@]pasteur-lille.fr
ORCID Number : 0000-0002-4438-6756
Sebastien FLEURY
Ingénieur d’étude. INSERM
sebastien.fleury[@]pasteur-lille.fr
ORCID Number : 0000-0002-0679-3086
Zouriatou GOUDA
Ingénieur d’étude. Université de Lille
zouriatou.gouda[@]pasteur-lille.fr
ORCID Number :0000-0001-5562-9322
Sandrine QUEMENER
Ingénieur d’étude. Université de Lille
sandrine.quemener[@]univ-lille.fr
ORCID Number :0000-0001-6369-3906
Marie-Laure JOSEPH
Technicienne Institut Pasteur de Lille
E-mail adress. marie-laure.joseph[@]pasteur-lille.fr
01.01.2025 : Arrivée du Dr Jonas Sondergaard, chef d’équipe émergente à l’Institut Pasteur de Lille, qui va étudier le rôle de l’hétérogénéité du système immunitaire dans la Stéatohépatite associé à une dysfonction métabolique (MASH) pour la médecine de précision.
01.01.2025 : Arrivée du Dr Janyerke Tulyeu, chercheur post-doctoral (collaboration avec B.Staels et D.Montaigne) sur un sujet intitulé : « Régulation immunitaire du remodelage cardiaque induite par le foie ».
- Modèles précliniques de maladies : Diabète de type 2, Obésité, Athérosclérose, NASH, Allergies alimentaires, Colite, Asthme allergique, Dermatite atopique, Psoriasis, Hypersensibilité de contact.
- Etudes translationnelles (collaborations avec le Prof. D. Staumont-Sallé, Département de Dermatologie, Hôpital Universitaire de Lille ; Prof. F. Pattou, Inserm U1190 et Département de Chirurgie Métabolique, Hôpital Universitaire de Lille et Prof. S. Francque, Département d’hépatologie, AZ Antwerpen (Belgique)).
- Cytométrie : Cytométrie spectrale, cytométrie de masse, tri cellulaire.
- Plateau d'Immunophénotypage Métabolique. www.egid.fr/plateformes/
- Pléthysmographie invasive.
- Histologie : Immunohistochimie, Microdissection par capture laser.
- Métabolisme intracellulaire : oxymétrie par technologie « Seahorse » ou SCENITH.
- Modèle murins génétiquement modifiées.
- Biologie moléculaire : (RT-PCR, microarrays).
Liste des financements obtenus entre 2018 et 2023 :
Financement Européens et Internationaux
2021 National Psoriasis Foundation (USA). Role of Pentose Phosphate Pathway in Dendritic cell migration in Psoriasis (38 000$) (coordinator).
2016-2022 European Research Council. Advanced. Bile acid, immune-metabolism, lipid and glucose homeostasis (2 500 000 € total ca. 800 000 € for Team 3). (Partner, Head immunology).
2017-2020 Francophone Fondation for Research on Diabetes (FFRD). Role of Treg-expressed RORα in type2 diabetes (coordinator) (300 000 €).
2017-2022 Leducq Foundation. https://www.fondationleducq.org/network/lean-leducq-epigenetics-of-atherosclerosis-network-defining-and-targeting-epigenetic-pathways-in-monocytes-and-macrophages-that-contribute-to-cardiovascular-disease. (500 000 $ total ca. 100 000 € for Team 3). (Partner, Immunology).
Financements publics nationaux
2018-2023 National Research Agency. Generic Program. Contribution of ILC and CD8 to Non-Alcoholic Steatohepatitis and progression towards hepatocarcinoma (partner) (183 000 €).
2021-2025 National Research Agency. Generic Program. Role of humanized IgE and FceRI in asthma and its potentiation by obesity (partner) (250 000 €).
2022-2026 National Research Agency. Generic Program. Metabolic control of IL-23 by resident and migratory dendritic cells (coordinator) (310 000 €).
2023-2027 National Research Agency. Generic Program. Defining adipose tissue macrophage diversity and function (partner) (150 000 €).
2023-2027 National Research Agency. Generic Program. Liver-induced immune-mediated regulation of cardiac remodeling (partner) (100 000 €).
Programme National d'Excellence
2010-2024 National Research Agency. Labex EGID. (European Genomic Institute of Diabetes). (Partner, Head of Axis 5. adipose tissue immune cells) (38 000 000 € total, ca. 1 000 000 € for Team 3).
2016-2021 National Research Agency. RHU PreCINASH. (Partner, Immunology) (1 800 000 € total).
2020-2021 iSite Université de Lille. Contribution of metainflammation to COVID 19 pneumonia in obese patients (coordinator) (79 000 €).
Financements par les fondations
2018-2021 Foundation for Medical Research (FRM). Cardiovascular diseases. Role of myeloid-expressed RORα in atherosclerosis (coordinator) (300 000 €).
2022-2025 Foundation for Medical Research (FRM). Equipe FRM Liver-induced immune-mediated regulation of cardiac remodeling (partner) (100 000 €) (362 000 € total, ca. 120 000 € for Team 3).
2023-2026 Foundation for Medical Research (FRM). Equipe FRM Regulation of dendritic cell function in psoriasis: the hexosamine biosynthetic pathway at the crossroad between glucose and glutamine metabolism (coordinator) (376 000 €).
Liste de 5 publications majeures :
- L'Homme, L., B.P. Sermikli, J. Haas, S. Quemener, S. Fleury, V. Guinot, E. Barreby, N. Esser, J. Noulette, B. Derudas, B. Legendre, V. Reverdy, N. Paquot, J. PIette, S. Legrand-Poels, M. Aouadi, F. Pattou, B. Staels, and D. Dombrowicz. 2024. Selective Immune and non-immune contribution to GDF-15 production in obesity, type 2 diabetes and NASH. Nature communications 15:7173. https://www.nature.com/articles/s41467-024-51078-2. Study of the source of satiety regulator GDF-15 production over the progressive development of obesity, type 2 diabetes and MASLD/MASH. Recruitment of inflammatory macrophages into adipose tissue is the main GDF-15 in obesity while stressed hepatocytes become the predominant source with the development of MASLD/MASH
- Ninni, S*., D. Dombrowicz*, T. Kuznetsova, R. Vicario, V. Gao, O. Molendi-Coste, J. Haas, E. Woitrain, A. Coisne, A.E. Neele, K. Prange, L. Willemsen, S. Aghezzaf, S. Fragkogianni, A. Tazibet, L. Pineau, J.R. White, J. Eeckhoute, M. Koussa, H. Dubrulle, F. Juthier, J. Soquet, A. Vincentelli, J.L. Edme, M. de Winther, F. Geissmann, B. Staels, and D. Montaigne. 2023. Hematopoietic Somatic Mosaicism Is Associated With an Increased Risk of Postoperative Atrial Fibrillation (* Equal Contribution). J Am Coll Cardiol 81:1263-1278. With editorial material. (Top 5% cited). https://www.sciencedirect.com/science/article/pii/S073510972300267X?via%3Dihub. Demonstration of the impact of hematopoietic somatic mutations on early and late postoperative events following aortic valve replacement surgery and correlation with preoperative immune status investigated using mass cytometry and RNAsequencing.
- D.A. Mogilenko, J.T. Haas, L. Lhomme, S. Fleury, S. Quemener, M. Levavasseur, C. Becquart, J. Wartelle, A. Bogomolova, L. Pineau, O. Molendi-Coste, S. Lancel, H. Dehondt, C. Gheeraert, A. Melchior, C. Dewas, A. Nikitin, S. Pic, N. Rabhi, J.S. Annicotte, S. Oyadomari, T. Velasco-Hernandez, J. Cammenga, M. Foretz, B. Viollet, M. Vukovic, A. Villacreces, K. Kranc, P. Carmeliet, G. Marot, A. Boulter, S. Tavernier, L. Berod, M.P. Longhi, C. Paget, S. Janssens, D. Staumont-Salle, E. Aksoy, B. Staels, D. Dombrowicz. Metabolic and innate immune cues merge into a specific inflammatory response via the UPR. Cell, 2019, 177, 1201-1216 (With editorial material. Avancée de l’Inserm 2019 (Top 5% cited). Mechanistic demonstration of the exacerbation of innate (TLR- and non TLR-mediated) immune response by fatty acids through inhibition of glycolysis, increased mtROS production and syngerstici activation of UPR with IL-23 as a signature hallmark. Therapeutic applications for psoriasis.
- J.T. Haas, L. Vonghia, D.A.Mogilenko, A. Verrijken, O. Molendi-Coste, S. Fleury, A. Deprince, A. Nikitin, E. Woitrain, L. Ducrocq-Geoffroy, S. Pic, B. Derudas, H. Dehondt, C. Gheeraert, L. Van Gaal, A. Driessen, P. Lefebvre, B. Staels, S. Francque, D. Dombrowicz. Transcriptional network analysis implicates altered hepatic immune function in NASH development and resolution. Nat. Metab., 2019, 1, 604-614 https://www.nature.com/articles/s42255-019-0076-1 With editorial material. (Top 5% cited). Demonstration of the importance of the DC-CD8 axis to NASH development in humans and in preclinical model.
- R. Paumelle, J.T. Haas, N. Hennuyer, E. Bauge, Y. Deleye, D. Mesotten, L. Langouche, J. Vanhoutte, C. Cudejko, K Wouters, S.A. Hannou, V. Legry, S. Lancel, F. Lalloyer, A. Polizzi, S. Smati, P. Gourdy, E. Vallez, E. Bouchaert, B. Derudas, H. Dehondt, C. Gheeraert, S. Fleury, A. Tailleux, A. Montagner, W. Wahli, G. Van Den Berghe, H. Guillou, D. Dombrowicz*, B. Staels*. (*equal contribution). Hepatic PPARα is critical in the metabolic adaptation to sepsis. J. Hepatol, 2019, 70, 963-973 (Top 10% cited). Demonstration of the key role of hepatocyte-expressed rather than immune-expressed PPARa in sepsis outcome through regulation of glycaemia and ketogenesis rather than through an anti-inflammatory effect.
Liste complète des publications de l'Equipe 3
David DOMBROWICZ
Chef d'équipe. Directeur de recherche. INSERM
david.dombrowicz[@]inserm.fr ; david.dombrowicz[@]pasteur-lille.fr ; david.dombrowicz[@]univ-lille.fr
Adresse postale : Inserm U1011. Institut Pasteur de Lille. 1, r. Prof. Calmette BP245. 59019 Lille Cedex. France



